01、ISO 10993-17:2002适用范围及目的
厂商在做医疗器械的生物学评估时,需要平衡产品的已知风险以及对患者的临床收益。其中,应考虑的因素就包括,暴露医疗器械产生的可沥滤物所带来的风险。针对该风险,厂商可以通过识别可沥滤物,进行风险量化,并将暴露量限制在可接受的范围内,从而控制使用者与有害可沥滤物接触的风险。
ISO 10993-17:2002规定了一种确定医疗器械可沥滤物容许限值的方法。它可以用于指导在不存在相关行业标准的情况下,估计适当的限值。该标准描述了一个系统过程,制造商通过该过程,可以量化毒理学危险物质引起的风险。制造商可以使用容许限值来优化生产工艺,帮助选择原材料,以保证使用安全。
但是,本标准不适用于未与患者直接或间接接触的器械,如体外诊断试剂或仪器。
02、什么是可沥滤物?
可沥滤物(Leachable substance)是指,通过水或其它与器械使用相关的液体的作用,从医疗器械中转移出的化学物质。例如,添加剂、灭菌剂残留物、工艺残留物、降解产物、溶剂、增塑剂、润滑剂、催化剂、稳定剂、抗氧化剂、着色剂、填充剂、和单体等。
03、相关的重要定义
容许极限 (Allowable limit, AL):通过暴露医疗器械进入人体时,每天可接受可沥滤物的最大量。(注:在每个暴露时间段内,允许的剂量限值以给患者的剂量表示。所使用的单位为“单位时间内的质量”,例如毫克每天。该剂量代表医疗器械在预期使用情况下的可接受风险。)
容许摄入量 (Tolerable intake, TI):在一定时期内,根据体重估算的某物质的平均每日摄入量,该物质被认为对健康没有明显危害。(注:通常以毫克/千克体重/天表示)
容许暴露量 (Tolerable exposure, TE):容许摄入量、体重和利用率的乘积。(注:通常以对病人毫克每天表示)
容许接触水平 (Tolerable contact level, TCL):与医疗设备器械接触导致的可沥滤物的容许接触暴露量。(注:通常以毫克每平方厘米身体表面积表示)
利用率 (Utilization factor, UTF):考虑使用频率和连接使用包含相同可沥滤物的其他医疗器械情况下的数值因子
04、确定容许限值的基本原则
确定可沥滤物容许限值的基本流程,主要分为三大步,具体内容可参考下图。
第一步:通过以下方式评估与可沥滤物有关的生物风险:
收集数据并确定关键的健康终点
确定特定的进入途径和暴露时间的容许摄入量
如果刺激是一个适当的终点,则确定容许接触水平
第二步:通过以下方式确定患者对可沥滤物的容许暴露量
确定适当的患者体重
根据器械利用率修改容许摄入量与体重的乘积;
第三步:确定可行性并在适当时应用收益。如果可行性评估确定TE在技术和经济上都是可行的,则TE成为容许的极限。如果不可行,则应根据具体情况对TE进行进一步修改,以确定容许的限值。
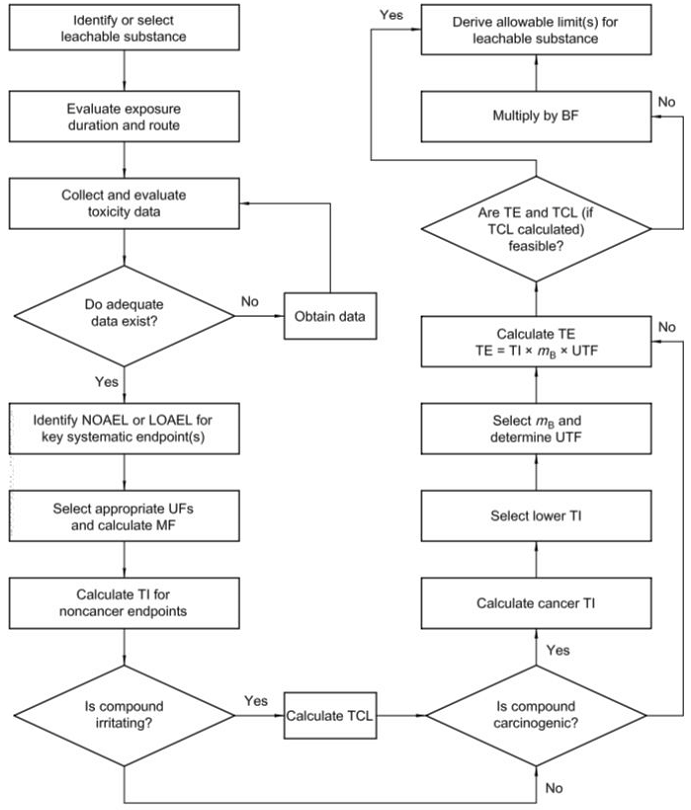
ISO 10993-17:2002可沥滤物容许限值确定标准解读(一)
(流程图中涉及的其它术语:NOAEL为未观察到不良事件的最大浓度;LOAEL为观察到不良反应的最低浓度;UF为不确定性因子;MF为修正因子;BF为收益因子)
从广义上来说,可沥滤物可以通过不同的途径进入人体,比如皮肤吸收、咽下、吸入等等。另外,根据使用时长,器械可以分为暂时使用、短期使用和长期使用。因此,对于每种使用类别,可能会因为暴露途径不同而具有多个限值。
特定的可沥滤物的总容许限值可以由三部分组成:即短期限值、延长限值和寿命限值。所以,可能需要考虑多种暴露途径下每种限值的情况。为此,针对每种使用类别中的每种接触途径,分别计算容许摄入量(TI)。在很多情况下,允许将最低TI值用于不同的使用类别和暴露途径,这样最能代表可沥滤物的毒理作用。
最后要特别注意的是,建立容许限量的第一步是识别可能危害健康的物质。所以,要尽可能多地收集可获取的科学数据,比如文献数据、网络数据等等。一旦识别并确认了有害物质,建立容许限值的过程就从确定容许摄入量开始。
05、两个关键点:
第一、在开展可沥滤物的生物学评估工作前
下一篇:欧洲医疗器械市场增长背后的几大推动力
- 欧盟SCCS发布关于二苯酮-2和二苯酮-5的科学建议
- 2025年6月20日,欧盟强制执行手机、平板、无绳电话生态设计(EU) 2023/1670及能效标签(EU) 2023/1669
- 美国新墨西哥州立法全面限制PFAS使用 2027年起分阶段禁用百余类产品
- 欧盟批准修订全氟辛基磺酸(PFOS)及其盐类和相关化合物限值
- 美国《加州第65号提案》2025年2月 “60天违规通知”分析
- 最新!FCC发布SAR测试新规!
- 充电桩IP等级测试 检测流程咨询
- 市场监管总局修订发布 生物降解材料PBAT国家标准
- 欧盟通过POPs法规中PFOS的修订草案
- GB 43631-2023《婴幼儿及儿童用纸品基本安全技术规范》


